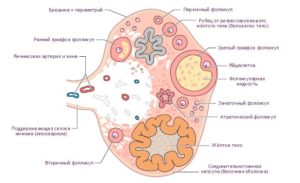
Строма яичника
Содержание
Эхография и допплерометрия для оценки эффективности лечения женщин с преждевременной недостаточностью яичников
Портативный аппарат для неотложной помощи, интенсивной терапии и спортивной медицины.
Исследования опорно-двигательного аппарата, мониторинг проведения анестезии и др.
Преждевременное угасание функции яичников — сложный, многофакторный и продолжительный процесс.
Термином «преждевременная недостаточность яичников» (ПНЯ) обозначают комплекс симптомов, формирующийся у женщин моложе 40 лет и включающий аменорею, признаки выраженного эстрогендефицита и бесплодие при повышенном уровне гонадотропинов (ФСГ, ЛГ) [1, 20].
В литературе обсуждается возрастной диапазон, который делает правомерным установление диагноза преждевременная недостаточность яичников. Возрастом формирования ПНЯ считают 35-43 года [8, 18, 19, 22], но большинство исследователей указывают на возраст до 40 лет [6].
В основе данной патологии, независимо от этиологического фактора, лежит несвойственное этому возрастному периоду уменьшение запаса примордиальных фолликулов вплоть до его полного истощения и формирования афолликулярного типа ПНЯ.
Это состояние описывается как «многофакторный синдром», обусловленный хромосомными аномалиями, генетическими нарушениями, ферментопатиями, инфекционными и ятрогенными факторами [14, 18].
Только в 5-10% случаев и лишь при наличии фолликулярного типа патологии, когда в яичниках обнаруживаются отдельные фолликулы, женщины с ПНЯ могут забеременеть [23, 28]. Согласно данным литературы у пациенток с ПНЯ беременности могут наступать на фоне приема эстрогенов и в циклах отмены КОК [27].Так, Alper [5] описал беременности у 6 пациенток с ПНЯ: 2 пациентки забеременели на фоне приема конъюгированных эстрогенов, 2-на фоне отмены оральных контрацептивов и 2 пациентки забеременели спонтанно. Возможно, что частота наступления беременности зависит от возраста начала заболевания.
Экзогенное введение эстрогенов сенсибилизирует клетки гранулезы, что по механизму обратной связи блокирует ФСГ и приводит к овуляции [6]. Комбинированные оральные контрацептивы действуют по механизму обратной связи на ЛГ- и ФСГ-рецепторы [11]. Однако исследования, посвященные использованию КОК для подавления гонадотропинов, показали, что эти препараты на фолликулярную активность не влияют [9].
Существует прямо пропорциональная зависимость между пулом примордиальных и числом растущих фолликулов, поэтому при снижении числа первых уменьшается размер когорты фолликулов, ежемесячно отбираемых в овуляторном цикле. Прижизненно объективно оценить овариальный пул невозможно, поэтому необходимы косвенные методы его определения.
По мнению некоторых авторов [24, 29] наряду с гормональными методами основным методом является эхография, включающая определение объема яичника и числа антральных фолликулов и дополненная цветовым допплеровским картированием яичникового кровотока (ЦДК).
Установлено, что объем яичника менее 3 см3 [29] и наличие в яичнике менее 5 антральных фолликулов являются неблагоприятным прогностическим признаком овариального резерва [24].
Число антральных фолликулов, обнаруженных с помощью трансвагинальной эхографии, отражает оставшийся пул «отдыхающих» примордиальных фолликулов, что подтверждается рядом работ, основанных на гистологических исследованиях, в которых была доказана прямая зависимость между числом примордиальных и растущих фолликулов [24, 29].
Репродуктивная система женщины уникальна тем, что в гормонально зависимых органах синхронно с гормональными фазами происходят выраженные колебания сосудистоготонуса. Адекватное кровоснабжение крайне необходимо для нормального функционирования яичников [3, 4]. Изменение кровотока в них связано с системным и локальным колебаниями уровней гормонов.
Питание малых примордиальных фолликулов происходит за счет близко расположенных стромальных сосудов. Снижение овариального кровотока, выявленное с помощью цветового допплеровского картирования, а не повышение уровня ФСГ, является более ранним маркером сниженного овариального резерва.Сниженное кровоснабжение яичника в свою очередь может приводить к резистентности яичника на гормональную стимуляцию и формирование яичниковой недостаточности.
В настоящее время для коррекции ранних, средневременных и поздних обменных нарушений, свойственных ПНЯ [1], назначают заместительную гормонотерапию. При этом используют препараты, в состав которых входят натуральные эстрогены в дозировках, временно обеспечивающих поддержание их концентрации в плазме крови на уровне ранней фолликулярной фазы менструального цикла.
Цель данного исследования — оценка изменения кровоснабжения яичников с помощью цветового допплеровского картирования кровотока в яичниковой артерии и ее стромальных ветвях и эхографическая характеристика органов малого таза у пациенток с ПНЯ, принимающих заместительную гормонотерапию.
Материалы и методы
Были обследованы 78 женщин с преждевременной недостаточностью яичников в возрасте от 18 до 40 лет (средний возраст 34,8±3,25) до и после 12 месяцев приема заместительной гормонотерапии.
В контрольную группу вошли 10 женщин репродуктивного возраста с сохраненным ритмом менструации, которым эхография органов малого таза проводилась на 3-й день цикла. Уровни гормонов (ФСГ, ЛГ, Е2 и Т) определяли методом ИФА с помощью соответствующих тест-систем на автоматическом анализаторе «Cobar Core II».
Трансвагинальное ультразвуковое исследование органов малого таза с ЦДК яичникового кровотока проводилось на аппарате экспертного класса с использованием мультичастотного трансвагинального датчика с частотой 8 — 6 — 4 МГц в режиме сканирования двумерной серой шкалы (B-mode), цветового допплеровского картирования (C-mode) и импульсного спектрального допплеровского режима (D-mode). При трансвагинальной эхографии органов малого таза вычисляли объем яичников и проводили подсчет антральных фолликулов в них, кроме того, измеряли размеры тела матки и изучали состояние эндометрия. При ЦДК визуализировали цветовые локусы, соответствующие расположению сосудов, и оценивали особенности их васкуляризации. Для получения допплеровской кривой выбирали локусы, размер и окно цветового допплеровского картирования, которые строго соответствовали обследуемой зоне. Угол цветового картирования был менее 60°С. Базовая линия устанавливалась по центру скоростной шкалы. Мощность выбирали максимальной, при которой не было артефактов. Для подавления возникающих шумов (цветовых артефактов) использовали частотный фильтр.
Анализ кривой скорости кровотока (КСК) проводили на протяжении не менее двух последовательных сердечных циклов. Полученные данные затем усредняли.
При исследовании доллеровской кривой обращали внимание на особенности ее формы: тип А — диастолический кровоток присутствует на протяжении всего сердечного цикла, тип В — отсутствует поздний диастолический кровоток, тип С — отсутствует ранний диастолический кровоток, тип D — диастолический кровоток отсутствует в раннюю диастолу, присутствует в среднюю и отсутствует в позднюю диастолу, тип 0 — диастолический кротовок полностью отсутствует [3].
Для количественной интерпретации спектральных кривых скоростей кровотока использовали индекс резистентности (ИР), пульсационный индекс (ПИ) и пиковую систолическую скорость кровотока (ПСС).
Заместительная гормонотерапия пациенткам с преждевременной недостаточностью яичников проводилась трехфазным препаратом дивисек (фирма Орион Фарма, Финляндия). Эстрогенный компонент в нем представлен эстрадиолом валеаратом, а гестагенный — медроксипрогестероном ацетатом (МПА).
Выбор данного препарата обусловлен тем, что в его состав входит гестаген с частичной андрогенной активностью.Согласно проведенному ранее исследованию [16] у пациенток, получающих в качестве эстрогена эфир эстрадиола (в данном случае эстрадиол валерат), расстройства аффективного спектра регрессируют быстрее, чем у пациенток, принимавших конъюгированные эстрогены.
Трехфазный режим приема дивисека позволяет избежать возобновления симптомов недостатка половых гормонов, возникающих в дни ожидаемых менструальноподобных реакций при двухфазном режиме. Препарат также активно предупреждает потерю костной ткани, которая сопровождает эстрогендефицитные состояния.
Мы назначали препарат дивисек в непрерывном режиме в течение 12 месяцев.
Статистическая обработка данных выполнена на компьютере с помощью электронных таблиц «Microsoft Excel» и пакета прикладных программ «Statistica for Windows» v. 7.0, StatSoft Inc. (США).
Результаты
Проведено проспективное клинико-лабораторное обследование 78 пациенток с ПНЯ (средний возраст 34,8±3,25 года). К моменту проведения исследования длительность заболевания составила 5,5±1,4 года, а возраст начала заболевания — 29,1±3,3 года. Начало нарушений ритма менструаций пришелся на возраст 27,3±1,1 года.
Среди причин, приведших к развитию ПНЯ, пациентки наиболее часто отмечали стрессовые факторы (26,92%), хотя у большинства больных (53,85%) непосредственную причину возникновения ПНЯ установить не удалось.
Начало заболевания по типу олигоаменореи выявлено у большинства пациенток (92,3%), только у 7,7% было внезапное прекращение менструаций по типу стойкой аменореи.
Все больные с ПНЯ предъявляли жалобы на вторичную аменорею, 58 (74,35%) — на повышенную утомляемость, 56 (71,8%) — на приливы, 53 (67,9%) — на бесплодие, 34 (43,6%) — на снижение либидо, 15 (19,23%) — на сухость во влагалище, 13 (16,67%) — на головокружение, 5 (6,41%) — на частое мочеиспускание, 5 (6,41%) — на прибавку в весе, 4 (5,13%) — на повышение артериального давления.
Выраженность симптомов дефицита половых гормонов по индексу Куппермана (15,75±1,4 балла) расценивалась как средне-тяжелая.
Средний уровень ЛГ и ФСГ у больных с ПНЯ значительно превышал нормативные показатели для женщин репродуктивного возраста, составляя 90,8±5,4 и 115,8±5,2 МЕ/л соответственно.
Концентрация эстрадиола (76,7±10,7 пмоль/л) у женщин с ПНЯ была значительно ниже нормативных показателей ранней фолликулиновой фазы у женщин с регулярными менструациями, при этом у 54 (69,23%) пациенток уровень эстрадиола не превышал 70 пмоль/л и в среднем составил 52,9±14,6 пмоль/л.
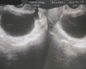
Интересно отметить, что в среднем по группе у женщин с ПНЯ уровень тестостерона составил 0,9±0,09 нмоль/л, а у 60,3% больных находился в пределах 0,2-0,9 нмоль/л и составил 0,61±0,1 нмоль/л, что расценивается как стойкое гипоандрогенное состояние.Для изучения размеров и внутренней структуры яичников 78 женщинам с ПНЯ была осуществлена трансвагинальная эхография органов малого таза (табл. 1) (рис. 1).
Таблица 1. Эхографическая характеристика яичников у пациенток с преждевременной недостаточностью яичников.
| Визуализация яичников с обеих сторон | 67 (85,9%) | 10 (100%) |
| Визуализация яичников только справа | 5 (6,4%) | — |
| Визуализация яичников только слева | 5 (6,4%) | — |
| Яичники не визуализируются с обеих сторон | 1 (1,28%) | — |
| Объем правого яичника, см3 | 1,82+0,21* | 5,8+1,7 |
| Объем левого яичника, см3 | 1,81+0,26* | 6,1+1,4 |
| Фолликулярный тип ПНЯ | 41 (53,3%)* | 10(100%) |
| До 5 антральных фолликулов | 31 (75,6%) | — |
| 5-10 антральных фолликулов | 10(24,4%)* | 10(100%) |
| Среднее число антральных фолликулов на яичник | 3,6+1,1* | 6,5+1,9 |
| Афолликулярный тип ПНЯ | 36 (46,7%) | — |
| Объем тела матки, см3 | 24,8+2,27* | 47,1+2,1 |
| М-эхо, см | 0,3+0,07 | 0,4+0,01 |
Примечание. * — Достоверное различие по отношению к контрольной группе (Р
Источник: https://www.medison.ru/si/art252.htm
Строение и основные нарушения стромы яичников
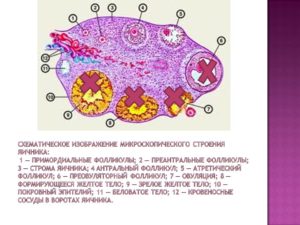
Текома яичника – это доброкачественная опухоль, обладающая гормональной активностью. Патология выявляется преимущественно в постменопаузе – после угасания функции гонад. Известны случаи развития болезни у девочек, не вступивших в период полового созревания (до первой в жизни менструации – менархе). В репродуктивном возрасте опухоль наблюдается крайне редко.
В Международной классификации болезней десятого пересмотра (МКБ-10) текома яичника числится под кодом D27 и относится к категории доброкачественных новообразований. По гистологической классификации она идет в группе опухолей стромы и полового тяжа.
Отличительная черта текомы яичника – это способность секретировать половые гормоны. Именно этот фактор определяет клинику заболевания.
Причины возникновения текомы яичника
Точные факторы развития болезни не изучены. Выделяют следующие возможные причины возникновения феминизирующей опухоли:
- Гипотеза непрерывной овуляции. Предполагается, что ежемесячное созревание фолликулов у современной женщины повышает риск развития опухолей яичников. В пользу этой теории говорит тот факт, что еще 100-200 лет назад, когда женщины рожали много детей (и овуляции случались реже на фоне постоянных беременностей и кормления грудью), заболевания яичника встречались не так часто.
- Гормональные нарушения, в том числе связанные с ранним половым созреванием и поздним наступлением менопаузы. В этой ситуации рост опухолей объясняют избытком эстрогена.
- Влияние неблагоприятных факторов: лучевое облучение, прием некоторых лекарственных средств и др.
- Генетическая предрасположенность.
Определенное значение придается эндокринным нарушениям и вредным привычкам.
Гистологические типы опухоли
По данным гистологического исследования выделяют такие варианты патологии:
- Типичная текома – опухоль из эпителиоидных клеток. Самый распространенный вариант патологии.
- Текома с лютеинизацией чаще выявляется у молодых женщин. Приводит к повышению уровня андрогенов.
- Фибротекома – опухоль, по строению похожая на фиброму яичника. Может достигать гигантских размеров. Склонна к рецидиву спустя 5 и более лет.
Симптомы патологии
Признаки текомы яичника зависят от ее клинической формы:
- Феминизирующий вариант встречается в преобладающем большинстве случаев. Возникает чаще в менопаузу, сопровождается повышением уровня эстрогенов.
- Вирилизирующая текома – редкий вариант опухоли. Встречается обычно в репродуктивном возрасте. Приводит к повышению уровня андрогенов.
Феминизирующая опухоль левого или правого яичника по-разному ведет себя в различные период жизни женщины:
- В возрасте до 8 лет текома яичника приводит к преждевременному половому созреванию. Отмечается рост наружных и внутренних половых органов, наблюдается оволосение на лобке и в подмышечных впадинах, увеличение молочных желез. Появляются ациклические кровянистые выделения из влагалища.
- В репродуктивном возрасте идет нарушение менструального цикла. Характерным признаком также являются ациклические вагинальные выделения. Реже отмечается увеличение объема и длительности нормальных менструаций.
- В постменопаузу текома яичника приводит к видимому омоложению женщины. Повышается тургор кожи, уходит сухость влагалища, возвращается половое влечение, нагрубают молочные железы. Появляются менструальноподобные выделения из половых путей.
Вирилизирующая текома приводит к появлению таких симптомов:
- Прекращение менструации.
- Избыточноеоволосение на лице и теле по мужскому типу.
- Уменьшение молочных желез в размерах.
- Огрубение голоса.
- Бесплодие.
Предварительный диагноз ставят на основании типичных жалоб женщины. Для определения тактики лечения требуется дополнительная диагностика.
Последствия текомы яичника
Феминизирующая опухоль приводит к повышению уровня эстрогена и сочетается с такой патологией:
- Миома матки – доброкачественная опухоль, растущая из миометрия (мышечного слоя органа).
- Аденомиоз, или внутренний эндометриоз – появление очагов слизистого слоя матки в миометрии.
- Гиперплазия эндометрия – избыточное разрастание слизистого слоя матки.
Все эти состояния утяжеляют течение болезни и могут стать показанием для радикального удаления органов репродуктивной системы.
Текома яичника – доброкачественная или злокачественная опухоль?
Текома – необычное образование. По умолчанию опухоль считается доброкачественной. Она не похожа ни на кисту, ни на рак яичника. В отличие от кистозных полостей, текома растет не за счет накопления жидкости, а в результате активного деления клеток. Но при этом опухоль не способна к инвазивному росту и метастазированию, что свойственно раку.
Отличительные черты текомы:
- Опухоль, даже не являясь злокачественной, может приводить к асциту (скоплению жидкости в брюшной полости) и гидротораксу (накоплению транссудата в плевральных полостях).
- Текома способна рецидивировать – вырастать на том же месте спустя 5-15 лет после ее удаления. По данным гистологии признаков раковой опухоли по-прежнему не выявляется.
Текома яичника может переродиться в злокачественное новообразование. Риск малигнизации небольшой и не превышает 2%.
Схема диагностики
В диагностике текомы применяются такие методы:
- Гинекологический осмотр. Бимануальное исследование позволяет выявить округлое эластическое образование в проекции придатков. В большинстве случаев опухоль односторонняя, поверхность ее может быть гладкой или бугристой.
- Гормональный профиль. Отмечается рост ФСГ и эстрадиола, тестостерона.
- Анализ крови на онкомаркеры. Тест на CA-125 не специфичен, однако повышение этого маркера с большой долей вероятности указывает на злокачественный процесс.
- Ультразвуковое исследование. При УЗИ текома определяется как округлое гипоэхогенное образование с четкими контурами. Внутренняя структура обычно однородная, без очаговых включений. При допплерометрии кровоток внутри доброкачественной опухоли отсутствует.
- Магнитно-резонансная томография. МРТ помогает уточнить диагноз и выявить признаки злокачественного перерождения.
- Гистологическое исследование (проводится после удаления опухоли). Текома покрыта белесоватой капсулой, на разрезе желтого цвета. Характерно появление участков некроза и кровоизлияний. У молодых женщин отмечается кальфицикация опухоли. Гистологическое исследование позволяет выставить окончательный диагноз и отличить доброкачественный процесс от злокачественного.
Как лечить текому яичника?
Лечение опухоли только хирургическое. Объем операции будет зависеть от возраста женщины, размера образованияи иных сопутствующих факторов. Возможны следующие варианты:
- Резекция яичника в пределах здоровых тканей. Удаляется только опухоль, орган сохраняется. Приоритетный метод у молодых женщин и девочек-подростков. Важно не просто удалить опухоль, но и сохранить функционально активную ткань яичника и овариальный резерв (запас фолликулов).
- Овариоэктомия – удаление опухоли вместе с яичником. Метод выбора в менопаузу.
Источник: https://zdorovo.live/ginekologiya/stroenie-i-osnovnye-narusheniya-stromy-yaichnikov.html